世界卫生组织,60年代中开始组织制订药品GMP,中国则从80年代开始推行。1988年颁布了中国的药品GMP,并于1992年作了第一次修订。十几年来,中国推行药品GMP取得了一定的成绩,一批制药企业(车间)相继通过了药品GMP认证和达标,促进了医药行业生产和质量水平的提高。国家药品监督管理局自1998年8月19日成立以来,历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)于2011年3月1日起施行。
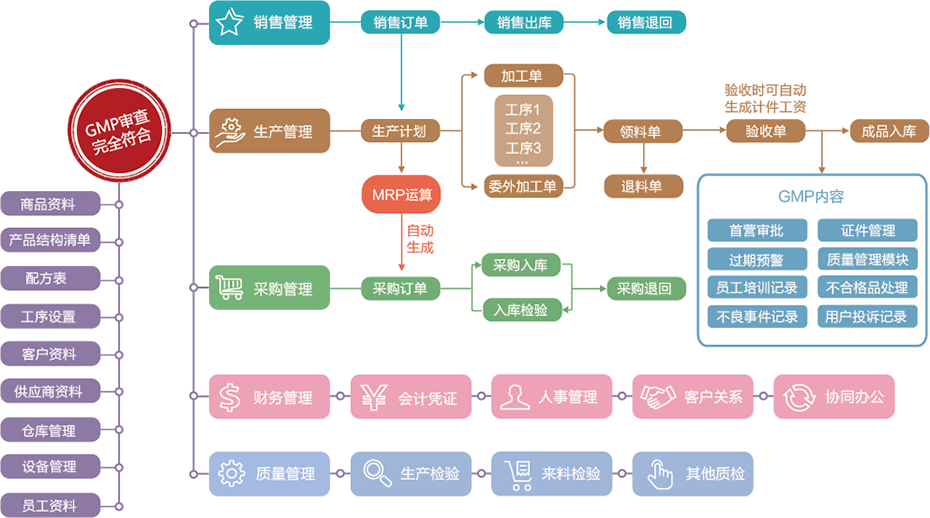
制药行业是典型的连续型生产制造企业,其生产能力相对稳定,企业关心物料的控制、产品的销售、质量的跟踪、生产的计划性、销售费用的控制及考核体系建立。GMP是制药企业的另一个执照,更注重范化管理,在物料流动的各个环节,以质量控制为先,对批次的跟踪要求切实有效,设备管理的体系较为完整。一般来说,该类企业的信息化投入强调整体效益,并且随着GMP、GSP的有效实施,企业也越来越规范。
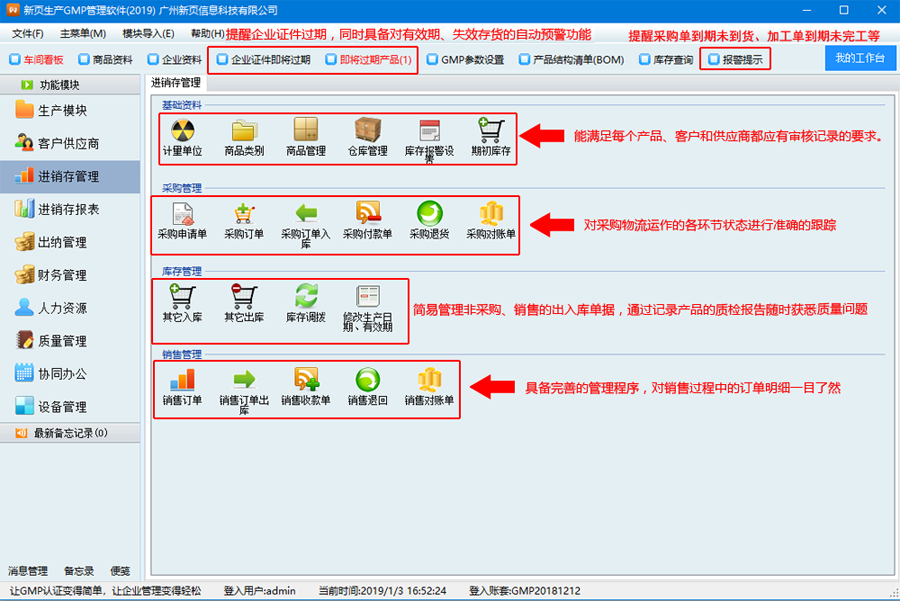
*医药企业一般采取统一采购,内部调拨到各药品经营公司后,进行药品对外销售;
*药品销售有3种模式:批发、零售、加价调拨;
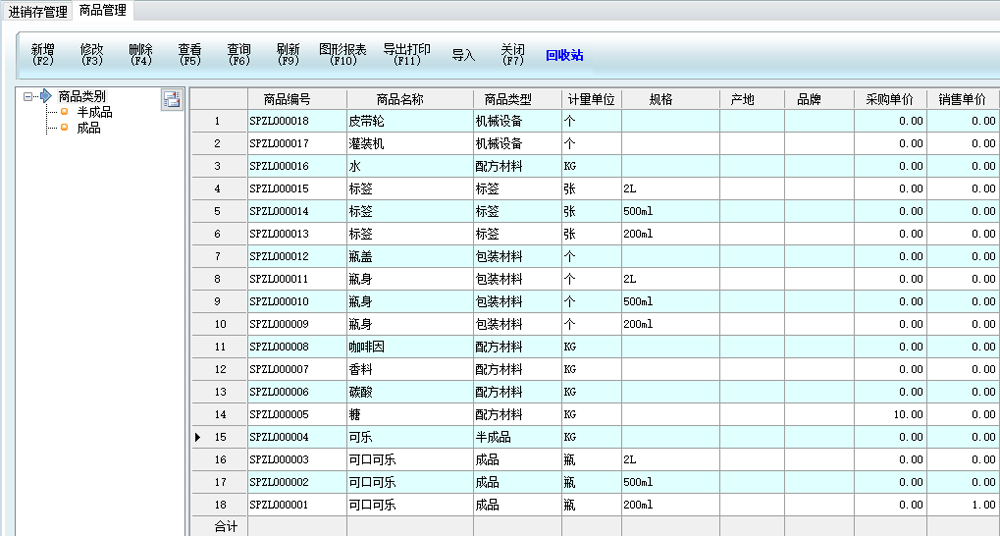
*对药品库存有严格的有效期、批次管理;
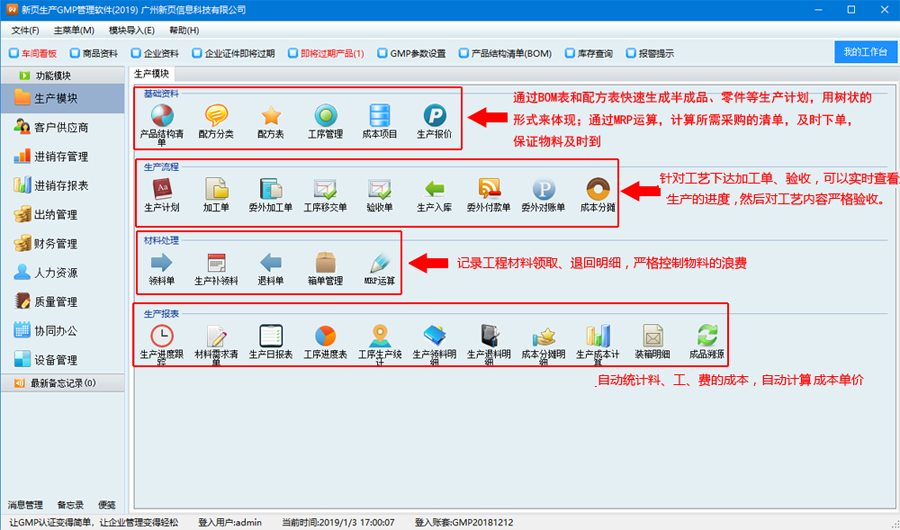
*生产型医药企业,要求有对车间进行的管理与核算;
*注重应收应付账款的管理,特别在釆购中,对供应商应付款的分析核算比较重视。
*重成本核算,一次投料,分批生产。
| 天津市康华健晔医用材料有限公司 | 思玛矫形科技(珠海)有限公司 | 四川圣上大健康药业限公司 | 陕西顿斯制药有限公司 |
| 四川弘一中药有限公司 | 广州市范乐医药科技有限公司 | 四川意和药业有限公司 | 河南发扬药业有限公司 |